Datos de tabla
• Gas Noble
• N° atómico: 2
• Grupo: 18
• Periodo: 1
• Subnivel p
• Masa atómica: 4,0026
• Electronegatividad: ---
• Estado de oxidación: 0
Para más información
Usos
Se emplea como gas de relleno en globos y zepelines publicitarios, de investigación atmosférica e incluso para realizar reconocimientos militares. Las atmósferas helio-oxígeno se emplean en la inmersión a gran profundidad, ya que el helio es inerte, menos soluble en la sangre que el nitrógeno y se difunde 2,5 veces más deprisa que él, todo lo cual reduce el tiempo requerido para la descompresión, aunque ésta debe comenzar a mayor profundidad, y elimina el riesgo de narcosis por nitrógeno (borrachera de las profundidades).
Por su bajo punto de licuefacción y evaporación puede utilizarse como refrigerante en aplicaciones a temperatura extremadamente baja como en imanes superconductores e investigación criogénica a temperaturas próximas al cero absoluto.
En cromatografía de gases se usa como gas portador inerte.
La atmósfera inerte de helio se emplea en la soldadura por arco y en la fabricación de cristales de silicio y germanio, así como para presurizar combustibles líquidos de cohetes.
En túneles de viento supersónicos.
Como agente refrigerante en reactores nucleares.
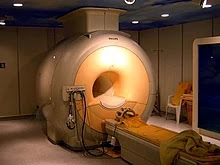
El helio líquido encuentra cada vez mayor uso en las aplicaciones médicas de la imagen por resonancia magnética.
El helio se usa como medio de enfriamiento para el Gran Colisionador de Hadrones (LHC) y los imanes superconductores en escáneres de resonancia magnética y espectrómetros de RMN. También se usa para mantener fríos los instrumentos satelitales y se usa para enfriar el oxígeno líquido y el hidrógeno que alimentan los vehículos espaciales Apollo.
Debido a su baja densidad, el helio se usa a menudo para llenar globos decorativos, globos meteorológicos y aeronaves. Una vez se utilizó hidrógeno para llenar globos, pero es peligrosamente reactivo.
Debido a que no es muy reactivo, el helio se usa para proporcionar una atmósfera inerte protectora para la fabricación de fibra óptica y semiconductores, y para la soldadura por arco. El helio también se usa para detectar fugas, como en los sistemas de aire acondicionado del automóvil, y debido a que se difunde rápidamente, se usa para inflar los airbags del automóvil después del impacto.
Se utiliza una mezcla de 80% de helio y 20% de oxígeno como atmósfera artificial para los buceadores de aguas profundas y otros que trabajan en condiciones de presión.
Los láseres de gas helio-neón se usan para escanear códigos de barras en cajas de supermercados. Un nuevo uso para el helio es un microscopio de iones de helio que ofrece una mejor resolución de imagen que un microscopio electrónico de barrido
Naturaleza
Después del hidrógeno, el helio es el segundo elemento más abundante en el universo. Está presente en todas las estrellas. Fue, y sigue siendo, formado a partir de la desintegración de partículas radiactivas de elementos radiactivos en la Tierra. Parte del helio formado se escapa a la atmósfera, que contiene alrededor de 5 partes por millón en volumen. Este es un equilibrio dinámico, con el helio de baja densidad que escapa continuamente al espacio exterior.
No es económico extraer helio del aire. La fuente principal es el gas natural, que puede contener hasta 7% de helio.
Descubrimiento
El helio fue descubierto por el francés Pierre Janssen y el inglés Norman Lockyer, en 1868 al analizar el espectro de la luz solar durante un eclipse solar, y encontrar una línea de emisión de un elemento desconocido. Eduard Frankland confirmó los resultados de Janssen y propuso el nombre helium para el nuevo elemento, en honor al dios griego del sol (helios) al que se añadió el sufijo -ium ya que se esperaba que el nuevo elemento fuera metálico. En 1895 Sir William Ramsay aisló el helio descubriendo que no era metálico, a pesar de lo cual el nombre original se conservó. Los químicos suecos Nils Langlet y Per Theodor Cleve consiguieron también, por la misma época, aislar el elemento. En 1908 el físico alemán Heike Kamerlingh Onnes produjo helio líquido enfriando el gas hasta 0,9 K, lo que le hizo merecedor del premio Nobel. En 1926 su discípulo Willem Hendrik Keesom logró por vez primera solidificar el helio.
Propiedades fisicoquímicas
Los gases nobles como el helio tienen poca tendencia a participar en reacciones químicas. El helio, como el resto de gases nobles presenta las siguientes propiedades: Es incoloro, inodoro y muestra una reactividad química muy baja en condiciones normales.
El estado del helio en su forma natural es gaseoso. El helio es un elmento químico de aspecto incoloro y pertenece al grupo de los gases nobles. El número atómico del helio es 2. El símbolo químico del helio es He. El punto de fusión del helio es de 0,95 grados Kelvin o de -271,2 grados celsius o grados centígrados. El punto de ebullición del helio es de 4,22 grados Kelvin o de -267,93 grados celsius o grados centígrados.
Impacto ambiental
No encontre info del elemento en sí sino de los globos que tienen helio
Impacto al ser humano
Su inhalación puede ser peligrosa si se hace en exceso, ya que es un gas asfixiante y desplaza al oxígeno necesario para la respiración normal. La respiración de helio puro continua, causa la muerte por asfixia en pocos minutos. La inhalación de helio directamente de cilindros a presión es extremadamente peligrosa, ya que la alta velocidad de flujo puede resultar en la ruptura de los tejidos pulmonares. Además su temperatura extremadamente baja puede causar quemaduras por congelación
El helio neutro en condiciones normales no es tóxico, no juega ningún papel biológico y se encuentra en trazas en la sangre humana
Usos en Argentina
El helio, un gas químicamente inerte, tiene un papel fundamental en un gran número de sectores y aplicaciones, incluyendo los escáneres de IRM, RMN, los semiconductores, los cables de fibra óptica, la investigación científica, la fabricación de airbags, la detección de fugas y el tratamiento térmico de superficie, entre otros
En imagenología, en estado líquido es utilizado en resonadores magnéticos para mantener superconductividad eléctrica del campo magnético. En diagnóstico, en estado gaseoso se utiliza en mezclas con oxígeno aprovechando las propiedades de este gas como fluido



Comentarios